Hvad er eksempler på de vigtigste interaktioner mellem molekyler hydrogenchlorid?
1. Dipole-dipol-interaktioner:
* Definition: Disse er attraktive kræfter mellem det positive ende af et polært molekyle og den negative ende af et andet polært molekyle.
* hcl: Det positive hydrogenatom af et HCl -molekyle tiltrækkes af det negative chloratom af et andet HCL -molekyle.
* påvirkning: Denne interaktion bidrager til det relativt høje kogepunkt af HCI sammenlignet med ikke -polære molekyler af lignende størrelse.
2. Hydrogenbinding:
* Definition: En speciel type dipol-dipolinteraktion, hvor et hydrogenatom er bundet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor) og tiltrækkes af det enlige par elektroner på et andet elektronegativt atom.
* hcl: Mens HCL ikke udviser * klassisk * hydrogenbinding (fordi klor ikke er så elektronegativ som O, N eller F), kan det deltage i svage hydrogenbindingsinteraktioner, især i opløsning.
* påvirkning: Disse svage interaktioner kan stadig påvirke egenskaber som opløselighed og reaktivitet.
3. London Dispersion Forces:
* Definition: Dette er midlertidige, svage attraktioner, der opstår fra de øjeblikkelige udsving i elektronskyer i alle molekyler (polære eller ikke -polære).
* hcl: Mens disse kræfter er svagere end dipol-dipol-interaktioner, bidrager de stadig til den samlede tiltrækning mellem HCL-molekyler.
* påvirkning: Disse kræfter er til stede i alle molekyler, uanset polaritet, og bliver mere signifikante for større molekyler med flere elektroner.
4. Ion-dipol-interaktioner (i løsninger):
* Definition: Disse forekommer, når en ion (enten positivt eller negativt ladet) interagerer med den modsatte ladede ende af et polært molekyle.
* hcl: I opløsning disserer HCl i H+ (proton) og Cl- (chlorid) ioner. Disse ioner kan derefter interagere med de polære vandmolekyler gennem ion-dipol-interaktioner.
* påvirkning: Dette er den primære årsag til, at HCL er meget opløselig i vand.
Sammendrag:
Interaktionerne mellem HCL-molekyler er en kombination af dipol-dipol, London-spredningskræfter og svag hydrogenbinding. Disse kræfter er ansvarlige for de fysiske egenskaber ved HCL, ligesom dens kogepunkt og opløselighed. I opløsning bliver ion-dipolinteraktioner med vand den dominerende kraft, hvilket fører til den høje opløselighed af HCI.
Sidste artikelHvilken ionisk forbindelse dannes, når brint og chlor kombineres?
Næste artikelHvordan afbalancerer du CH3OH O2 giver CO2 H2O?
 Varme artikler
Varme artikler
-
 Undersøgelse viser, at tryk inducerer usædvanligt høj elektrisk ledningsevne i polyiodidDen elektroniske energi af I5- beregnet i vakuum, som funktion af δ1 og δ2. Farven angiver destabiliseringen fra den symmetriske I5-. De hvide cirkler repræsenterer poster i Cambridge Structural Datab
Undersøgelse viser, at tryk inducerer usædvanligt høj elektrisk ledningsevne i polyiodidDen elektroniske energi af I5- beregnet i vakuum, som funktion af δ1 og δ2. Farven angiver destabiliseringen fra den symmetriske I5-. De hvide cirkler repræsenterer poster i Cambridge Structural Datab -
 Forskere afslører det molekylære grundlag for synKredit:CC0 Public Domain Forskere har løst den tredimensionelle struktur af et proteinkompleks involveret i hvirveldyrs syn ved atomopløsning, et fund, der har brede implikationer for vores forstå
Forskere afslører det molekylære grundlag for synKredit:CC0 Public Domain Forskere har løst den tredimensionelle struktur af et proteinkompleks involveret i hvirveldyrs syn ved atomopløsning, et fund, der har brede implikationer for vores forstå -
 Skræddersyning af overfladen af kulstof kan indeholde nøglen til overvågning af patientblod i r…Det uendelige antal lokale atomstrukturer dannet af kulstof kan grupperes i et par motiver med karakteristiske atomare og elektroniske egenskaber. Kredit:Aalto University De potentielle anvendelse
Skræddersyning af overfladen af kulstof kan indeholde nøglen til overvågning af patientblod i r…Det uendelige antal lokale atomstrukturer dannet af kulstof kan grupperes i et par motiver med karakteristiske atomare og elektroniske egenskaber. Kredit:Aalto University De potentielle anvendelse -
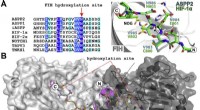 Hydroxyleringen af ASPP2 og andre ankyrin-gentagelsesdomæneproteinerUdsigter fra krystalstrukturer af FIH i kompleks med ASPP-afledte peptider. En (venstre) sekvensjustering af ASPP-proteiner med rapporterede FIH-substrater. (Højre) Overlejring af krystalstrukturafled
Hydroxyleringen af ASPP2 og andre ankyrin-gentagelsesdomæneproteinerUdsigter fra krystalstrukturer af FIH i kompleks med ASPP-afledte peptider. En (venstre) sekvensjustering af ASPP-proteiner med rapporterede FIH-substrater. (Højre) Overlejring af krystalstrukturafled
- Forskere lokaliserer potentiel magmakilde i italiensk supervulkan
- Hvor meget stærkere er tyngdekraften end
- Klimaforandringerne har forværret den globale økonomiske ulighed
- Forskere tager to skridt mod grønt brændstof
- For vingårde, konkurrence øger profitten fra bæredygtighed
- DNA-baseret metode detekterer spormængder af jordnødder i fødevarer


