Hvordan illustrerer hydrazin og ammoniak loven i flere proportioner?
loven i flere proportioner
Denne lov siger, at når to elementer kombineres for at danne mere end en forbindelse, er masserne af det ene element, der kombineres med en fast masse af det andet element, i et simpelt forhold.
illustrerer loven med hydrazin og ammoniak
* nitrogen og brint: Både hydrazin og ammoniak er sammensat af nitrogen (N) og hydrogen (H) atomer.
* Fast masse nitrogen: Lad os overveje en fast nitrogenmasse, for eksempel 14 gram (som er den molære masse af nitrogen).
* masseforhold af brint:
* ammoniak (NH₃): 14 gram nitrogen kombineres med 3 gram brint (3 x 1 gram/mol h).
* hydrazin (n₂h₄): 14 gram nitrogen kombineres med 4 gram brint (4 x 1 gram/mol h).
Forholdet:
Forholdet mellem masserne af brint, der kombineres med den faste masse nitrogen (14 gram) er 3:4. Dette enkle forhold (3:4) demonstrerer loven i flere proportioner.
Forklaring
De forskellige forhold mellem brint i hydrazin og ammoniak skyldes de forskellige måder, nitrogen- og brintatomer kombinerer. Ammoniak har et nitrogenatom for hvert tre hydrogenatomer (NH₃), mens hydrazin har to nitrogenatomer for hver fire hydrogenatomer (N₂H₄). Den faste nitrogenmasse i hver forbindelse har en anden mængde brint, og denne forskel er i et enkelt forhold mellem hele antal.
Nøglepunkter:
* Loven i flere proportioner gælder for forbindelser dannet fra de samme elementer, men med forskellige proportioner.
* Forholdet mellem masser af elementerne er altid et simpelt forhold mellem hele tal.
Fortæl mig, hvis du har yderligere spørgsmål!
Sidste artikelHvad er CO2 -reaktionen med hydrazinhydrat?
Næste artikelNår acetone reagerer med hydrazin i ethanol, hvad dannes der?
 Varme artikler
Varme artikler
-
 Hvad er det hvide på min påskechokolade, og kan jeg stadig spise det?Kredit:Shutterstock Ordene chokolade og skuffelse går ikke ofte sammen. Men du har måske oplevet en vis skuffelse, hvis du nogensinde har pakket den lyse folie af et påskeæg ud for at opdage hvid,
Hvad er det hvide på min påskechokolade, og kan jeg stadig spise det?Kredit:Shutterstock Ordene chokolade og skuffelse går ikke ofte sammen. Men du har måske oplevet en vis skuffelse, hvis du nogensinde har pakket den lyse folie af et påskeæg ud for at opdage hvid, -
 Afsløring af trans-fedtsyrers grimme virkning i blodetForbrug af transfedtsyrer, findes ofte i forarbejdede fødevarer, øger risikoen for hjertesygdomme og slagtilfælde. Kredit:Creative Commons Zero (CC0) licens Tohoku University forskere har fundet u
Afsløring af trans-fedtsyrers grimme virkning i blodetForbrug af transfedtsyrer, findes ofte i forarbejdede fødevarer, øger risikoen for hjertesygdomme og slagtilfælde. Kredit:Creative Commons Zero (CC0) licens Tohoku University forskere har fundet u -
 Et skridt i retning af følsom og hurtig glutenopdagelseKredit:American Chemical Society For mennesker med cøliaki og glutenfølsomhed, antallet af madmuligheder i butikkerne vokser. Men de nuværende test for gluten finder ikke alt stoffet i fødevarer,
Et skridt i retning af følsom og hurtig glutenopdagelseKredit:American Chemical Society For mennesker med cøliaki og glutenfølsomhed, antallet af madmuligheder i butikkerne vokser. Men de nuværende test for gluten finder ikke alt stoffet i fødevarer, -
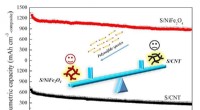 Nikkelferrit fremmer lithium-svovlbatteriets kapacitet og cyklusstabilitetSammenlignet med S/CNTer, S/NiFe2O4 har højere volumetrisk kapacitet og cykelstabilitet. Kredit:©Science China Press Lithium-svovl (Li-S) batteri kan blive praktisk, hvis 20 procent af de teoretis
Nikkelferrit fremmer lithium-svovlbatteriets kapacitet og cyklusstabilitetSammenlignet med S/CNTer, S/NiFe2O4 har højere volumetrisk kapacitet og cykelstabilitet. Kredit:©Science China Press Lithium-svovl (Li-S) batteri kan blive praktisk, hvis 20 procent af de teoretis
- Atomer af forskellige elementer forenes under kemiske ændringer for at producere hvad?
- Forskere bygger kunstige cellulære rum som molekylære værksteder
- Giv ikke Las Vegas skylden for Colorado Rivers problemer
- NASA går til opsendelse til den planlagte Artemis I-månemission
- Tsunamien udløst af Anak Krakatoa-udbruddet var mindst 100 meter høj
- Undersøgelse ser på, hvordan det globale energimix kan ændre sig i løbet af de næste 20 år


