Hvis 57,0 ml BaCl2 -opløsning er nødvendig for at udfælde al sulfation i en 742 mg prøve Na2SO4, hvilken molaritetsopløsning?
1. Skriv den afbalancerede kemiske ligning:
Bacl₂ (aq) + na₂so₄ (aq) → Baso₄ (s) + 2naCl (aq)
2. Beregn mol af na₂so₄:
* Molmasse Na₂so₄ =(2 * 22,99 g/mol) + (32,07 g/mol) + (4 * 16,00 g/mol) =142,04 g/mol
* Mol na₂so₄ =(742 mg / 1000 mg / g) / 142,04 g / mol =0,00522 mol
3. Bestem mol af bacl₂ nødvendigt:
* Fra den afbalancerede ligning reagerer 1 mol bacl₂ med 1 mol na₂so₄.
* Derfor er der behov for 0,00522 mol bacl₂.
4. Beregn molariteten af bacl₂ -løsningen:
* Molaritet =mol opløst / volumen af opløsning (i liter)
* Volumen af bacl₂opløsning =57,0 ml =0,0570 L
* Molaritet af bacl₂ =0,00522 mol / 0,0570 L = 0,0916 m
Derfor er molariteten af bacl₂ -opløsningen 0,0916 m.
Sidste artikelPåvirker valenselektroner reaktiviteten af et element?
Næste artikelHvilke metaller findes naturligt?
 Varme artikler
Varme artikler
-
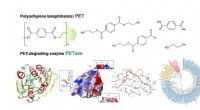 Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder
Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder -
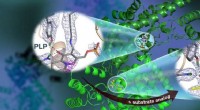 Neutroner observerer vitamin B6-afhængig enzymaktivitet, der er nyttig til lægemiddeludviklingEt ORNL-ledet team brugte neutroner til at observere AAT-enzymet, et vitamin B6-afhængigt protein, og fandt ud af, at den kemiske reaktion kun fandt sted på ét aktivt sted. Nuklear spredningslængde tæ
Neutroner observerer vitamin B6-afhængig enzymaktivitet, der er nyttig til lægemiddeludviklingEt ORNL-ledet team brugte neutroner til at observere AAT-enzymet, et vitamin B6-afhængigt protein, og fandt ud af, at den kemiske reaktion kun fandt sted på ét aktivt sted. Nuklear spredningslængde tæ -
 Hook-on medicin:Ny leveringsstrategi for K-Ras disruptionDr. Ohkanda holder sammensætningen strategisk designet til at hægte sig ind i hullet i enzymet. Kredit:Junko Ohkanda Ph.D., Professor i Akademisk Forsamling, Landbrugsinstituttet, Shinshu Universitet
Hook-on medicin:Ny leveringsstrategi for K-Ras disruptionDr. Ohkanda holder sammensætningen strategisk designet til at hægte sig ind i hullet i enzymet. Kredit:Junko Ohkanda Ph.D., Professor i Akademisk Forsamling, Landbrugsinstituttet, Shinshu Universitet -
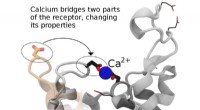 Forstå en celles dørklokkeFremme af design af lægemidler til bedre medicinske effekter kræver en kombination af eksperimentel og computersimuleringsforskning. Forskere ved Los Alamos National Laboratory, University of Toronto,
Forstå en celles dørklokkeFremme af design af lægemidler til bedre medicinske effekter kræver en kombination af eksperimentel og computersimuleringsforskning. Forskere ved Los Alamos National Laboratory, University of Toronto,
- Når du navngiver forbindelsen, der indeholder calcium- og klorændringssuffikset af navn til?
- Ingeniører designer programmerbare RNA-vacciner:Test i mus viser, at de virker mod ebola, influenza…
- Hvor mange N2O4 -molekyler er i 8,16 g N2O4?
- End of the road for bakspejl?
- Hvor mange atomer med brint er i 0,180 mol carbonhydroxid?
- Hvad gør mennesker til mennesker?


