Forskere afslører menneskelig DNA-reparation ved nuklear metamorfose

Forskere ved University of Toronto har opdaget en DNA-reparationsmekanisme, der fremmer forståelsen af, hvordan menneskelige celler forbliver sunde, og som kan føre til nye behandlinger for kræft og for tidlig aldring.
Undersøgelsen, offentliggjort i tidsskriftet Nature Structural and Molecular Biology , kaster også lys over virkningsmekanismen af nogle eksisterende kemoterapi-lægemidler.
"Vi tror, at denne forskning løser mysteriet om, hvordan DNA-dobbeltstrengen går i stykker, og kernekappen forbindes til reparation i menneskelige celler," siger professor Karim Mekhail, co-principal investigator på undersøgelsen og professor i laboratoriemedicin og patobiologi ved U. T's Temerty Medicinske Fakultet.
"Det gør også mange tidligere offentliggjorte opdagelser i andre organismer anvendelige i forbindelse med menneskelig DNA-reparation, hvilket burde hjælpe videnskaben med at bevæge sig endnu hurtigere."
DNA-dobbeltstrengsbrud opstår, når celler udsættes for stråling og kemikalier og gennem interne processer såsom DNA-replikation. De er en af de mest alvorlige typer af DNA-skader, fordi de kan stoppe cellevækst eller sætte den i overdrev, hvilket fremmer aldring og kræft.
Den nye opdagelse, lavet i menneskelige celler og i samarbejde med professor Razqallah Hakem, en forsker ved University Health Network og professor ved Temerty Medicine, udvider tidligere forskning i DNA-skader i gær udført af Mekhail og andre videnskabsmænd.
I 2015 viste Mekhail og samarbejdspartnere, hvordan motorproteiner dybt inde i kernen af gærceller transporterer dobbeltstrengede brud til "DNA hospitalslignende" proteinkomplekser indlejret i kernehylsteret ved kanten af kernen.
Andre undersøgelser afslørede relaterede mekanismer under DNA-reparation i fluer og andre organismer. Forskere, der udforsker lignende mekanismer i humane og andre pattedyrsceller, rapporterede imidlertid om ringe eller ingen DNA-mobilitet i de fleste pauser.
"Vi vidste, at nukleare kappeproteiner var vigtige for DNA-reparation på tværs af de fleste af disse organismer, så vi spekulerede på, hvordan vi kunne forklare den begrænsede mobilitet af beskadiget DNA i pattedyrsceller," siger Mekhail.
Svaret er både overraskende og elegant.
Når DNA inde i kernen af en menneskelig celle er beskadiget, dannes et specifikt netværk af mikrotubuli filamenter i cytoplasmaet omkring kernen og skubber på kernehylsteret. Dette medfører dannelsen af bittesmå rør, eller tubuli, som når ind i kernen og fanger de fleste dobbeltstrengede brud.
"Det er ligesom fingre, der skubber på en ballon," siger Mekhail. "Når du klemmer en ballon, danner dine fingre tunneler i dens struktur, som tvinger nogle dele af ballonens ydre ind i sig selv."
Yderligere forskning fra undersøgelsens forfattere detaljerede flere aspekter af denne proces. Enzymer kaldet DNA-skaderespons-kinaser og tubulinacetyltransferase er hovedregulatorerne for processen og fremmer dannelsen af tubuli.
Enzymer afsætter et kemisk mærke på en bestemt del af mikrotubulus filamenter, som får dem til at rekruttere bittesmå motoriske proteiner og skubbe på kernehylsteret. Følgelig skubber de reparationsfremmende proteinkomplekser kappen dybt ind i kernen og skaber broer til DNA-brudene.
"Dette sikrer, at kernen gennemgår en form for reversibel metamorfose, hvilket gør det muligt for kappen midlertidigt at infiltrere DNA gennem hele kernen, fange og genforbinde ødelagt DNA," siger Mekhail.
Resultaterne har betydelige konsekvenser for nogle kræftbehandlinger.
Normale celler bruger kernehylsterets tubuli til at reparere DNA, men kræftceller ser ud til at have mere brug for dem. For at udforske mekanismens potentielle virkning analyserede holdet data, der repræsenterede over 8.500 patienter med forskellige kræftformer. Behovet var synligt i flere kræftformer, herunder triple-negativ brystkræft, som er meget aggressiv.
"Der er en enorm indsats for at identificere nye terapeutiske veje for kræftpatienter, og denne opdagelse er et stort skridt fremad," siger Hakem, seniorforsker ved UHNs Princess Margaret Cancer Center og professor i U of T's afdeling for medicinsk biofysik og afdeling i laboratoriemedicin og patobiologi.
"Indtil nu var forskerne uklare med hensyn til den relative indvirkning af den nukleare kappe i reparationen af beskadiget DNA i menneskelige celler. Vores samarbejde afslørede, at målretningsfaktorer, der modulerer den nukleare kappe for beskadiget DNA-reparation, effektivt begrænser udviklingen af brystkræft," siger Hakem .
I den aggressive triple negative brystkræft er der forhøjede niveauer af tubuli, sandsynligvis fordi de har mere DNA-skade end normale celler. Da forskerne slog de gener, der var nødvendige for at kontrollere tubuli, ud, var kræftceller mindre i stand til at danne tumorer.
En medicin, der bruges til at behandle tredobbelt negativ brystkræft, er en klasse af lægemidler kaldet PARP-hæmmere. PARP er et enzym, der binder til og hjælper med at reparere beskadiget DNA. PARP-hæmmere blokerer enzymet i at udføre reparation, hvilket forhindrer enderne af et DNA-dobbeltstrengsbrud i kræftceller i at genoprette forbindelsen til hinanden.
Kræftcellerne ender med at forbinde to knækkede ender, der ikke er en del af det samme par. Efterhånden som flere mismatchede par skabes, bliver de resulterende DNA-strukturer umulige for celler at kopiere og dele sig.
"Vores undersøgelse viser, at lægemidlets evne til at udløse disse uoverensstemmelser afhænger af tubuli. Når færre tubuli er til stede, er kræftceller mere modstandsdygtige over for PARP-hæmmere," siger Hakem.
Partnerskaber mellem forskere inden for forskellige områder var afgørende for fundene i kræftceller. Undersøgelsen understreger vigtigheden af tværfagligt samarbejde, siger Mekhail.
"Hjernekraften bag hvert projekt er afgørende. Ethvert teammedlem tæller. Desuden er enhver ret samarbejdspartner, der føjes til forskningsprojektet, det samme som at opnå endnu en doktorgrad i et nyt speciale; det er stærkt," siger han.
Mekhail bemærker, at opdagelsen også er relevant for for tidlig ældningstilstande som progeria. Den sjældne genetiske tilstand forårsager hurtig aldring inden for de første to årtier af livet, hvilket almindeligvis fører til tidlig død.
Progeria er forbundet med et gen, der koder for lamin A. Mutationer i dette gen reducerer stivheden af den nukleare kappe. Holdet fandt ud af, at ekspression af mutant lamin A er tilstrækkelig til at inducere tubuli, som DNA-skadelige midler forstærkede yderligere. Holdet mener, at selv et svagt pres på den nukleare kappe ansporer til dannelsen af tubuli i for tidlig ældning af celler.
Resultaterne tyder på, at i progeria kan DNA-reparation blive kompromitteret af tilstedeværelsen af for mange eller dårligt regulerede tubuli. Studieresultaterne har også betydning for mange andre kliniske tilstande, siger Mekhail.
"Det er spændende at tænke på, hvor disse resultater vil føre os næste gang," siger Mekhail. "Vi har fremragende kolleger og utrolige praktikanter her hos Temerty Medicine og på vores partnerhospitaler. Vi arbejder allerede på at følge denne opdagelse og bruge vores arbejde til at skabe nye terapier."
Flere oplysninger: DNA-dobbeltstrenget break-fangende nuklear kappe-tubuli driver DNA-reparation, Nature Structural &Molecular Biology (2024). DOI:10.1038/s41594-024-01286-7
Journaloplysninger: Naturens strukturelle og molekylære biologi , Naturstrukturel og molekylærbiologi
Leveret af University of Toronto
 Varme artikler
Varme artikler
-
 En smart løsning til at genoprette østersrevKredit:University of Adelaide Forskere fra University of Adelaide bruger undervandsmusik til at fremskynde restaureringen af indfødte østersrev. Ved at bruge undervandshøjttalerteknologi udsende
En smart løsning til at genoprette østersrevKredit:University of Adelaide Forskere fra University of Adelaide bruger undervandsmusik til at fremskynde restaureringen af indfødte østersrev. Ved at bruge undervandshøjttalerteknologi udsende -
 Melkraft til at øge fødevaresikkerhedenAustralsk hvede tiltrækker traditionelt en høj pris på markedet. Kredit:University of Queensland Opdagelsen af gener, der bestemmer udbyttet af mel fra hvede, kunne øge formalingsudbyttet, øge f
Melkraft til at øge fødevaresikkerhedenAustralsk hvede tiltrækker traditionelt en høj pris på markedet. Kredit:University of Queensland Opdagelsen af gener, der bestemmer udbyttet af mel fra hvede, kunne øge formalingsudbyttet, øge f -
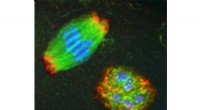 Ny indsigt i hovedårsagen til abort, opdaget fødselsdefekterEn spindel (top, venstre) er en udførlig fodboldformet struktur, der fysisk adskiller kromosomer under celledeling, sikre, at hver nydelt celle får den korrekte mængde genetisk materiale. Den blå repr
Ny indsigt i hovedårsagen til abort, opdaget fødselsdefekterEn spindel (top, venstre) er en udførlig fodboldformet struktur, der fysisk adskiller kromosomer under celledeling, sikre, at hver nydelt celle får den korrekte mængde genetisk materiale. Den blå repr -
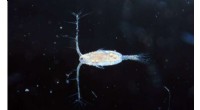 Eksperimentel evolution:Marine copepoder kan genetisk tilpasse sig skiftende havforholdCopepod forstørret. De små krebsdyr kan tilpasse sig skiftende miljøfaktorer - så længe ikke for mange stressfaktorer kommer sammen. Kredit:Alexandra Hahn/GEOMAR Copepoder er blandt de vigtigste or
Eksperimentel evolution:Marine copepoder kan genetisk tilpasse sig skiftende havforholdCopepod forstørret. De små krebsdyr kan tilpasse sig skiftende miljøfaktorer - så længe ikke for mange stressfaktorer kommer sammen. Kredit:Alexandra Hahn/GEOMAR Copepoder er blandt de vigtigste or
- Store skotter! det er et unikt sprogligt fænomen
- Skulpturering af stabile strukturer i rene væsker
- Tidligt valg af matematik blandt amerikanske immigrantbørn fører til STEM-karrierer
- Lyndata mere nyttige end tidligere antaget
- Solstormundersøgelser foretaget af gamle assyriske astronomer
- I Amerika, rejser med højhastighedstog er af sporet


