Hvilken temperatur er reaktionen ved ligevægt?
* ligevægt er dynamisk: Det er ikke en enkelt temperatur, men en tilstand, hvor hastighederne for de fremadgående og omvendte reaktioner er ens. Dette betyder, at koncentrationerne af reaktanter og produkter forbliver konstante over tid, men reaktionen sker stadig.
* Temperaturpåvirkninger ligevægt: Ligevægtskonstanten (K) er temperaturafhængig. Ændringer i temperaturen skifter ligevægtspositionen til at favorisere enten den forreste eller omvendte reaktion.
* specifikke oplysninger nødvendige: For at finde ligevægtstemperaturen har du brug for:
* Den specifikke reaktion: Forskellige reaktioner har forskellige ligevægtskonstanter.
* ligevægtskonstanten (K) værdi: Dette indikerer de relative mængder af reaktanter og produkter i ligevægt.
* Enthalpiændringen (ΔH) af reaktionen: Dette fortæller dig, om reaktionen er eksoterm (frigiver varme) eller endotermisk (absorberer varme).
Sådan finder du ligevægtstemperaturen:
1. Bestem ligevægtskonstanten (K) ved en kendt temperatur. Du kan finde dette i tabeller eller beregne det ved hjælp af eksperimentelle data.
2. Brug Van't Hoff -ligningen til at beregne K ved forskellige temperaturer. Denne ligning relaterer K, ΔH og temperatur.
3. Find temperaturen, hvor K er lig med den ønskede værdi. Dette repræsenterer temperaturen, hvorpå reaktionen er i ligevægt under de givne betingelser.
Eksempel:
Lad os sige, at du vil finde den temperatur, hvorpå reaktionen A + B ⇌ C har en ligevægtskonstant på 10. Du ved, at ΔH er -50 kJ/mol. Du kan bruge Van't Hoff -ligningen og værdien af K ved en kendt temperatur til at beregne den temperatur, hvorpå k =10.
Husk, at temperaturen ved ligevægt ikke er en fast værdi for en reaktion, men afhænger af de specifikke betingelser.
Sidste artikelEn ion, der indeholder en kovalent bundet gruppe atomer?
Næste artikelHvad er natriummetaller?
 Varme artikler
Varme artikler
-
 For at opsnuse kriminalitet og forsvundne personer, videnskaben støtter bloddetektionshundeHunde kan pålideligt opsnuse menneskeblod, selv efter to års miljøforringelse. Kredit:Jason Korbol/shutterstock Det er svært at overveje tragedien ved at miste en elsket en og aldrig vide, hvad de
For at opsnuse kriminalitet og forsvundne personer, videnskaben støtter bloddetektionshundeHunde kan pålideligt opsnuse menneskeblod, selv efter to års miljøforringelse. Kredit:Jason Korbol/shutterstock Det er svært at overveje tragedien ved at miste en elsket en og aldrig vide, hvad de -
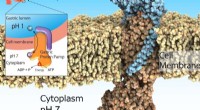 Forskere etablerer krystalstruktur af gastrisk protonpumpeDen gastriske protonpumpe, også kendt som H+, K+-ATPase, udtrykkes på overfladen af maven for at udskille mavesyren, der er uundværlig for fordøjelsen af proteiner i maden. Imidlertid, for meget s
Forskere etablerer krystalstruktur af gastrisk protonpumpeDen gastriske protonpumpe, også kendt som H+, K+-ATPase, udtrykkes på overfladen af maven for at udskille mavesyren, der er uundværlig for fordøjelsen af proteiner i maden. Imidlertid, for meget s -
 In-situ kemiundersøgelser for µSRKredit:Lucy Moorcraft/SINE2020 På grund af den kemiske analogi mellem muonium (et bundet muon-elektronsystem) og brint, muon-teknikken tilbyder en værdifuld metode til at udforske mange mekanismer
In-situ kemiundersøgelser for µSRKredit:Lucy Moorcraft/SINE2020 På grund af den kemiske analogi mellem muonium (et bundet muon-elektronsystem) og brint, muon-teknikken tilbyder en værdifuld metode til at udforske mange mekanismer -
 Redoxdivergerende strategi til konstruktion af (dihydro)thiophener med dimethylsulfoxidKredit:Pixabay/CC0 Public Domain (dihydro)thiophener, blandt de mest almindelige femleddede heterocykler, er udbredt i et stort antal naturlige produkter, funktionelle materialer, og biologisk akt
Redoxdivergerende strategi til konstruktion af (dihydro)thiophener med dimethylsulfoxidKredit:Pixabay/CC0 Public Domain (dihydro)thiophener, blandt de mest almindelige femleddede heterocykler, er udbredt i et stort antal naturlige produkter, funktionelle materialer, og biologisk akt
- Mystisk interstellar besøgende var sandsynligvis et mørkt brint-isbjerg, ikke udlændinge
- Bedste geologiske kort skabt til en europæisk rover på Mars
- Hvor meget energi har en foton af frekvens 6 x 1012 Hz?
- Hvilke grupper af elementer har forskellige anklager?
- Hvad er symbolet for en gennemsnitlig hastighed af et objekt?
- Hvad er de kemiske egenskaber ved brint?


